摘要
目的 探讨如何选择和评价液相色谱-串联质谱(LC-MS/MS)检测血清25-羟基维生素D[25(OH)D]替代校准品基质。
方法 分别用4%牛血清白蛋白(BSA)溶液和30%乙醇水溶液2种替代基质,配制25(OH)D的标准溶液并绘制标准曲线。通过比较内标在不同基质中的响应值差异及基质效应混合实验、准确度验证,对替代基质进行全面的评价。
结果 内标在4% BSA和血清样本中的响应值差异无统计学意义(P>0.05),在30%乙醇水溶液和血清样本中的响应值差异有统计学意义(P<0.05)。4% BSA溶液通过了基质效应混合实验验证,30%乙醇水溶液未通过;使用4% BSA基质的标准曲线对室间质量评价样本的定量结果满足准确度要求;30%乙醇水基质未满足要求,有2个样本的定量结果偏移>25%。
结论 4% BSA可作为LC-MS/MS检测人血清25(OH)D的替代校准品基质。
血清25-羟基维生素D[25-hydroxyvitamin D,25(OH)D]水平常被用于评价人体维生素D的营养状况。因自然界中维生素D的主要存在形式包括维生素D2(麦角钙化醇)和维生素D3(胆钙化醇)2种,因此医学实验室采用25-羟基维生素D2[25-hydroxyvitamin D2,25(OH)D2]和25-羟基维生素D3[25-hydroxyvitamin D3,25(OH)D3]的总和来反映体内25(OH)D的水平。目前,医学实验室检测血清25(OH)D的方法主要有免疫分析法和色谱质谱法。液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)因其灵敏度高、特异性好等优势,被认为是检测血清25(OH)D的“金标准”[1,2,3]。但与免疫分析法相比,LC-MS/MS测定25(OH)D可选择的商品化试剂盒有限,性能不一[4],不能满足实际检测过程中对准确度、线性范围等性能参数的要求,因此多数医学实验室采用自建方法开展检测。医学实验室自建LC-MS/MS方法检测25(OH)D[5,6]时,必须重视配制标准溶液所用的替代校准品基质(空白基质)的选择与评价,若替代校准品基质与血清样本基质有显著差异,会产生基质效应差异,导致待测物及其同位素内标物在不同基质中的色谱质谱响应信号不一致,产生基质互通性问题,影响检测方法的准确度和精密度。因此,选择合适的替代校准品基质,并对其与血清样本基质的互通性进行全面、合理的评价,对医学实验室自建准确、可靠的LC-MS/MS方法检测25(OH)D至关重要。本研究对LC-MS/MS检测25(OH)D替代校准品基质进行了系统、全面的评价。文献报道的LC-MS/MS检测25(OH)D的替代校准品基质有3%~8%牛血清白蛋白(bovine serum albumin,BSA)溶液或纯溶剂基质[7]。回顾已发表的文献[5,8-9],综合考虑操作简便、成本低等因素,本研究选择对4% BSA和30%乙醇水作为备选替代校准品基质进行评价。
1 材料和方法
1.1 研究对象
收集6份广州金域医学检验中心有限公司表观健康志愿者捐献的人血清样本,所有志愿者均知情同意;另收集10份2016年英国维生素D室间质量评价计划(Vitamin D External Quality Assessment Scheme,DEQAS)[1,10]样本,编号为486~490、496~500,DEQAS样本基质来源于接受放血治疗的血色病或红细胞增多症志愿者;本研究所使用的25(OH)D2和25(OH)D3靶值由DEQAS提供,由美国国家标准与技术研究院(the National Institute of Standards and Technology,NIST)参考测量程序赋值。
1.2 替代校准品基质的配制及测定
1.2.1 替代校准品基质配制(1)4% BSA溶液。准确称取40.0 g BSA粉末,采用pH7.5的磷酸盐缓冲液溶解,并定容到1 L,配制成4% BSA溶液。(2)30%乙醇水溶液。准确移取30 mL无水乙醇溶液,采用去离子水定容到100 mL,充分混合,配制成30%乙醇水溶液。
1.2.2 校准物质溶液和同位素内标溶液配制 (1)分别准确称取1.00 mg的25(OH)D2和25(OH)D3标准物质,用0.50 mL无水乙醇进行溶解后,稀释至12.5 μg/mL,配制成25(OH)D校准物质溶液。(2)分别准确称取1.00 mg d6-25(OH)D2和d6-25(OH)D3同位素内标物质,用1.00 mL无水乙醇进行溶解后,再用乙腈稀释至50.0 ng/mL,配制成25(OH)D同位素内标溶液。
1.2.3 标准曲线绘制 分别以4% BSA溶液和30%乙醇水溶液为基质,将一定体积的25(OH)D2和25(OH)D3标准物质溶液加入替代校准品基质中,配制成浓度分别为2.20、3.13、6.25、12.50、25.00、60.00、100.00 ng/mL的标准溶液并绘制标准曲线。
1.2.4 样本测定 参照文献[11]的液液萃取样本前处理方法,分别对实验样本进行前处理。采用液相色谱串联质谱仪进行测定。(1)液相条件。采用C18色谱柱(50.0 mm×2.1 mm),柱温为50 ℃,进样量为40 μL;流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸甲醇溶液,初始梯度为73%流动相B,2.4~3.1 min为92%流动相B,3.1~5.0 min恢复至初始梯度73%流动相B。(2)质谱条件。采用正离子多反应监测模式,25(OH)D2、25(OH)D3及其同位素内标的离子对分别为413.4>395.2、419.4>401.3、401.4>383.3、407.2>389.4,喷雾电压为5 500 V,离子源温度为450 ℃,碰撞能为13 V。
1.2.5 仪器及试剂 美国SCIEX公司API4000系列LC-MS/MS仪;标准物质25(OH)D2(纯度≥98.0%)、25(OH)D3(纯度≥99.0%)、BSA、无水乙醇(色谱级)均购自美国Sigma-Aldrich公司[4],同位素内标物质d6-25(OH)D2(纯度≥99%)、d6-25(OH)D3(纯度≥99%)购自美国Medical Isotopes公司[5],室内质控样品ClinChek Serum Control购自德国Recipe公司,甲酸(色谱级)购自美国CNW公司,甲醇(色谱级)、乙腈(色谱级)、正己烷(色谱级)购自美国Merck KGaA公司。
1.3 替代校准品基质评价实验
1.3.1 同位素内标在不同基质中的响应值差异比较实验 取4% BSA和30%乙醇水,2种替代校准品基质的标准溶液各1组,按照样本测定方法对6份不同来源的人血清样本进行检测,每个样本各检测1次,计算3种不同基质中同位素内标d6-25(OH)D2和d6-25(OH)D3的峰面积均值,并采用Kruskal-Wallis分析对多组变量进行相关性分析。
1.3.2 基质效应混合实验 取配制好的25(OH)D校准物质溶液,分别用4% BSA和30%乙醇水进行稀释,配制成30 ng/mL的溶液B(4% BSA基质)和溶液C(30%乙醇水基质);6份不同来源的血清样本编号为A1~A6,分别与溶液B、溶液C按不同比例混合,得到混合基质样本AB1~AB6、AC1~AC6。将A1~A6、溶液B、溶液C、AB1~AB6、AC1~AC6按照样本测定方法进行检测,每个样本平行检测3次,分别计算25(OH)D2和25(OH)D3的响应比值(响应比值=待测物峰面积/同位素内标峰面积);比较混合基质样本的25(OH)D2和25(OH)D3响应比值与混合前基质响应比值的平均值之间的差异,若差异<20%,则说明无相对基质效应[6,12-13],基质效应验证通过。
1.3.3 准确度评价实验 取4% BSA和30%乙醇水,2种替代校准品基质的标准曲线各1组,按照样本测定方法检测10份DEQAS样本,每份样本检测1次,分别绘制2种基质标准曲线的回归方程,采用内标定量法分别计算10份DEQAS样本的浓度,并进行定量分析,将所得定量结果分别与DEQAS提供的靶值进行比较,计算相对偏移,并采用Passing-Bablok对数据进行相关性分析。
1.4 统计学分析
采用MedCalc 15.2、GraphPad Pinsm 5.01和Excel2010软件进行统计分析。计量数据以x±s表示;采用Kruskal-Wallis分析进行多组变量的相关性分析,以P<0.05为差异有统计学意义;采用Passing-Bablok进行2组数据的相关性分析。
2 结果
2.1 同位素内标在不同基质中的响应差异
d6-25(OH)D2和d6-25(OH)D3在4% BSA基质中的响应值分别为(6.750±0.359)×105 cps、(15.000±0.317)×105 cps,与其在血清基质中的响应值差异无统计学意义(P>0.05);d6-25(OH)D2和d6-25(OH)D3在30%乙醇水基质中的响应值分别为(3.700±0.265)×105 cps、(8.040±0.609)×105 cps,与其在血清基质中的响应值差异有统计学意义(P<0.05)。见表1和图1。
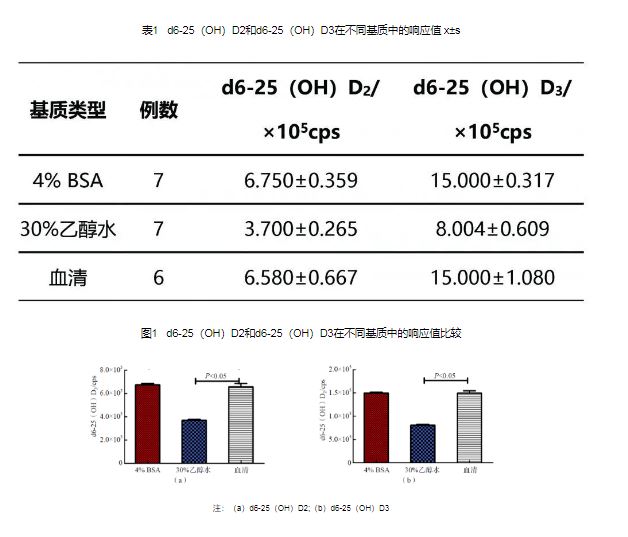
注:(a)d6-25(OH)D2;(b)d6-25(OH)D3
2.2 基质效应混合实验
混合样本AB1~AB6的响应比值均在可接受范围内,说明4% BSA基质与血清基质之间无相对基质效应。混合样本AC1~AC6的响应比值结果中,AC5混合样本的25(OH)D2响应比值与理论响应比值之间的相对偏移>20%,说明30%乙醇水基质与血清基质之间存在相对基质效应,基质效应验证未通过。见表2、表3、图2。
表2 25(OH)D2基质效应混合实验结果
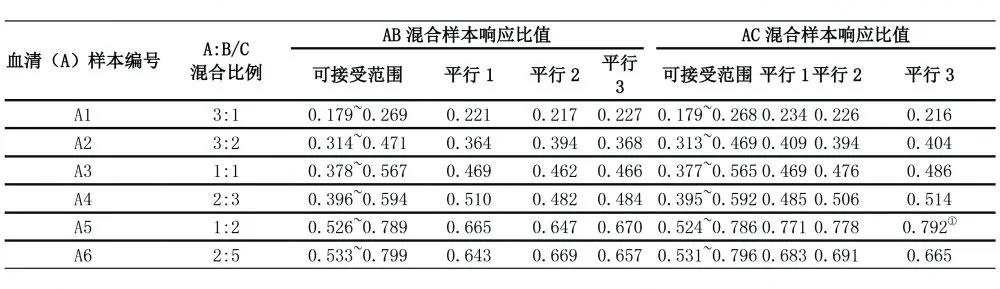
注:①该样本超出理论可接受范围
表3 25(OH)D3基质效应混合实验结果
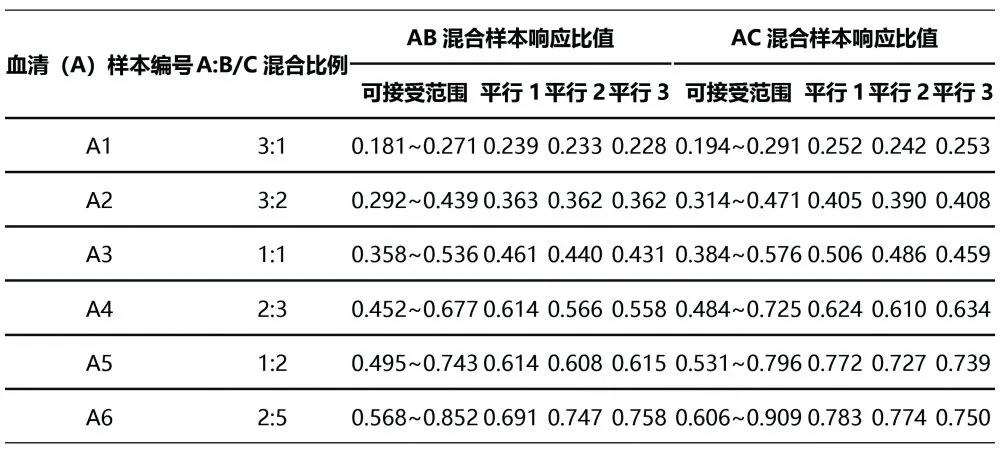
图2 混合样本AB1~AB6、AC1~AC6响应比值与理论响应比值的相对偏移
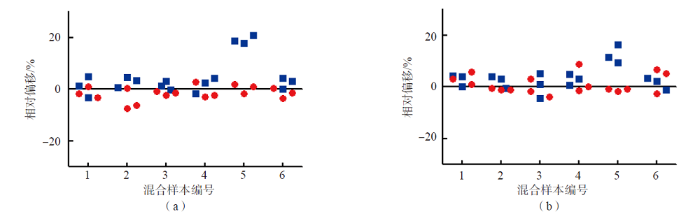
注:(a)25(OH)D2;(b)25(OH)D3; ● 4% BSA(AB);■ 30%乙醇水(AC)
2.3 准确度评价
由于所选DEQAS样本25(OH)D2结果均低于本方法的定量限(2.2 ng/mL),因此在准确度结果分析时,仅采用25(OH)D的结果,即25(OH)D2与25(OH)D3之和进行分析。4% BSA基质的校准曲线定量所得DEQAS样本结果与靶值的相对偏移<4%,30%乙醇水基质的校准曲线定量所得DEQAS样本结果与靶值的相对偏移均>20%,其中2个结果偏移>25%,超出可接受范围。Passing-Bablok相关性分析结果显示,2种基质的曲线所得结果与靶值的相关性拟合方程分别为:Y=-0.586 6+1.033 7X,Y=0.533 4+1.235 4X。4% BSA基质的校准曲线定量结果与靶值的一致性较好。见表4、表5、图3。
表4 4% BSA得出的标准曲线对DEQAS样本的定量结果
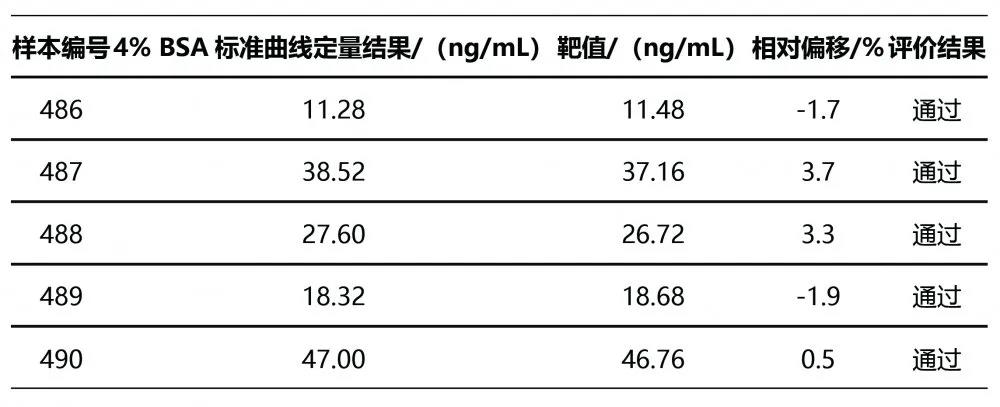
表5 30%乙醇水得出的标准曲线对DEQAS样本的定量结果
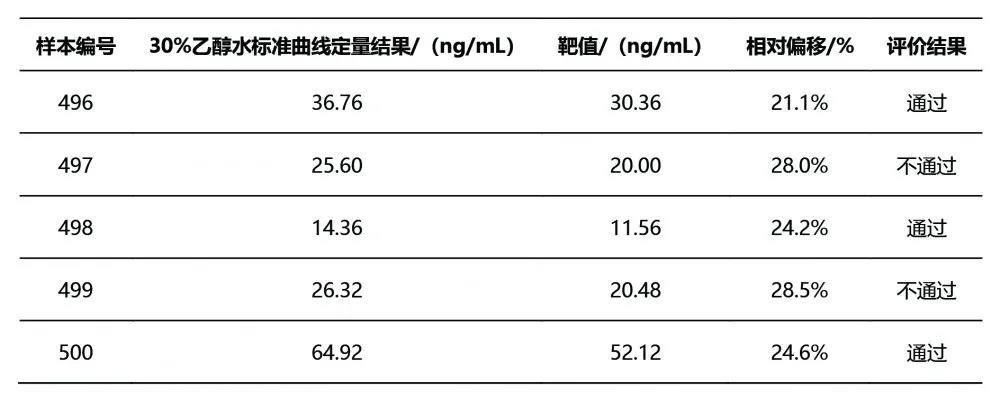
图3 2种基质标准曲线所得定量结果与靶值之间的Passing-Bablok相关性分析
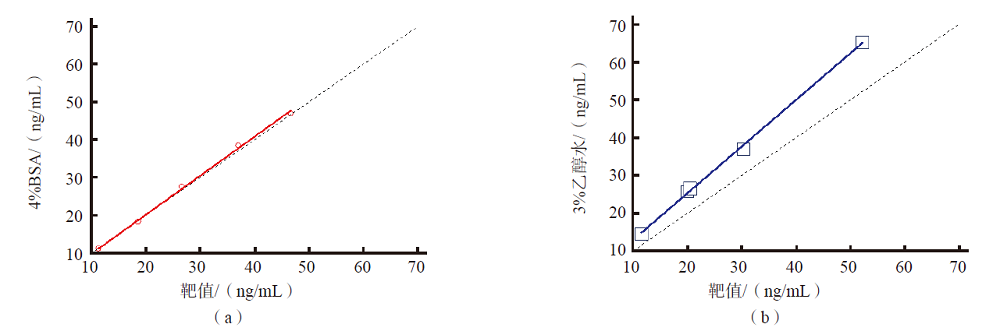
注:(a)为4% BSA基质;Y=-0.586 6+1.033 7X;(b)为30%乙醇水基质;Y=-0.533 4+1.235 4X
3 讨论
本研究系统地探讨了选择和评价替代校准品基质的方法,以LC-MS/MS检测人血清25(OH)D的2种替代校准品基质——4% BSA和30%乙醇水为例,通过比较d6-25(OH)D2和d6-25(OH)D3同位素内标在2种基质中的响应值差异、2种基质的相对基质效应验证及2种基质的标准曲线对有靶值的DEQAS样本的定量准确度差异,全面评价了2种替代校准品基质,并最终确定4% BSA为适用的替代校准品基质。以4% BSA为替代校准品基质,作为标准溶液或室内质量控制的配制材料,实验室易于获得、成本低、质量易于控制,弥补了商品化标准溶液准确度等性能参数不稳定、室内质控品浓度不合理、价格昂贵等缺点,可以满足大规模检测的需求。
稳定同位素内标在样本预处理、色谱分离、质谱离子化和裂解过程中,与待测物几乎一致,因此使用稳定同位素内标被认为是校正基质效应最便捷的有效手段[8,14]。但有研究发现,待测物及其内标在质谱中离子抑制或离子增强的程度不一致时,待测物与内标有不同的基质效应。在配制标准溶液时,尤其需要注意这种情况的发生,避免选择不合适的标准溶液基质[12]。因此,本研究在评价替代校准品基质时,以同位素内标d6-25(OH)D2和d6-25(OH)D3在不同基质中的响应值差异来反映25(OH)D2和25(OH)D3的响应值差异;通过基质效应混合实验评价待测物和内标在不同基质中的差异一致性,即内标对待测物基质效应的校正情况;并通过配制不同替代校准品基质的溶液,对有靶值的人源基质DEQAS样本进行定量检测,评价基质差异对定量准确度的影响。
本研究在基质效应验证实验中,选择了6份不同来源的志愿者血清样本基质进行混合基质效应评价,可能存在所用血清基质不能全面反映实际检测中患者血清样本基质的复杂性,无法完全地评价相对基质效应的真实情况。因此,实验室在自建LC-MS/MS方法、选择替代校准品基质时,除评价基质效应外,检测有靶值的DEQAS样本是很好的选择。本研究中,依据30%乙醇水基质标准曲线得出的定量结果与靶值的平均偏移>20%,而4% BSA基质得出的标准曲线对DEQAS样本的定量结果与靶值的差异<4%,即不同基质间的基质效应,在4% BSA中可通过同位素内标[d6-25(OH)D2和d6-25(OH)D3]校正,不影响检测性能,但在30%乙醇水中不能完全校正,会影响检测性能。
本研究还发现,30%乙醇水基质中的内标信号显著低于血清基质,而4% BSA基质中的内标响应值与血清中的内标响应值差异无统计学意义(P>0.05)。这可能是因为血清样本基质中存在蛋白等多种杂质,仅仅通过液液萃取无法完全去除[9],最终处理后的样本基质与30%乙醇水等纯溶剂基质对同位素内标d6-25(OH)D2和d6-25(OH)D3的基质效应,即离子增强或抑制的情况,存在显著差异,从而产生了响应值的差异。因此,在本研究建立的检测25(OH)D的LC-MS/MS方法中,替代校准品基质4% BSA优于纯溶剂基质30%乙醇水溶液。有文献报道可使用纯溶剂[8]作为替代校准品基质,用于血清中维生素D代谢产物的LC-MS/MS检测,与本研究结论不一致,这可能与不同的LC-MS/MS方法对基质效应的祛除程度不同有关,也进一步说明了不同的实验室在建立检测25(OH)D的LC-MS/MS方法时,均有必要对所选的替代校准品基质进行评价。
随着LC-MS/MS技术在医学实验室的应用,越来越多的自建方法和商品化试剂盒被研发出来,但无论是自建方法还是商品化试剂盒,均需要解决替代校准品基质选择与评价的问题,以建立准确的检测方法并实现准确定量。本研究提供了一种替代校准品基质评价方案,可供实验室自建LC-MS/MS方法或试剂生产者参考。
参考文献:
[1]赵蓓蓓,程雅婷,董衡,等.25羟基维生素D检测方法的可靠性分析[J]. 临床儿科杂志,2017,35(12):957-960.
[2]韩吉春,王小臣,李广林,等.液相色谱-串联质谱法检测干血点样本中25-羟基维生素D2和25-羟基维生素D3[J]. 分析化学,2017,45(3):448-454.
[3]霍记平,赵志刚.25(OH)D检测方法的研究进展[J]. 药品评价,2016,13(8):24-26.
[4]王少亭,李艳.液相色谱-质谱联用技术在临床检验中的应用与发展[J]. 中华检验医学杂志,2016,39(8):650-653.
[5]中华医学会检验医学分会,卫生计生委临床检验中心.液相色谱-质谱临床应用建议[J]. 中华检验医学杂志,2017,40(10):770-779.
[6]中国医师协会检验医师分会临床质谱检验医学专业委员会.液相色谱串联质谱临床检测方法的开发与验证[J]. 检验医学,2019,34(3):189-196.
[7]袁小芬,马金飞,杨青青,等.液相色谱-串联质谱技术在维生素检测中的应用[J]. 中华检验医学杂志,2019,42(6):479-483.
[8]BUNCH D R,EL-KHOURY J M,GABLER J,et al.Do deuterium labeled internal standards correct for matrix effects in LC-MS/MS assays? A case study using plasma free metanephrine and normetanephrine[J]. Clin Chim Acta,2014,429:4-5.
[9]Clinical and Laboratory Standards Institute.Liquid chromatography-mass spectrometry methods;approved guideline. C62-A CLSI,2014.来源:检验医学 2021 , 36 (2): 213-218
[10]周琰,潘柏申.维生素D检测标准化进程[J]. 检验医学,2016,31(1):71-75.
[11]程雅婷,董衡,梁晓翠,等.人血清中25羟基维生素D测定的两种质谱方法比较[J]. 中华临床医师杂志(电子版),2013,7(14):6535-6537.
[12]王思和,程雅婷,赵蓓蓓,等. 临床色谱质谱检验技术[M]. 北京:人民卫生出版社,2017.
[13]冯晓杰,杜丽英,冯章英,等.LC-MS/MS法测定人血药浓度的基质效应研究进展[J]. 中国新药杂志,2015,24(13):1488-1492.
[14]刘晓云,陈笑艳,钟大放.液相色谱-串联质谱生物分析方法的基质效应和对策[J]. 质谱学报,2017,38(4):388-399.
来源:检验医学 2021 , 36 (2): 213-218

