David G. McLaren, Steven J. Stout, Sheng-Ping Wang, Paul L. Miller, Kithsiri Herath, Vinit Shah, Ablatt Mahsut, Jose Castro-Perez, Douglas G. Johns, Michele Cleary, Stephen F. Previs, and Thomas P. Roddy Merck Research Laboratories, Merck & Co., Inc. Rahway, NJ 07065-0900 USA
脂质是普遍存在的分子,服务于多种重要的生物功能,包括能量储存(甘油三酯)、细胞膜结构和功能的调节(磷脂和胆固醇)、细胞内信号和激素调节。脂质代谢异常可导致多种疾病,包括动脉粥样硬化、高甘油三酯血症和2型糖尿病。因此,了解脂质在体内的合成、调节和运输对于开发和改进新的治疗方法非常重要。稳定同位素已被用于研究脂质代谢的几个方面,包括:胆固醇、磷脂、低密度脂蛋白甘油三酯的合成与处理。在这个应用指南中,我们强调使用稳定同位素标记的脂肪酸作为底物来研究小鼠体内脂质代谢的一些优点和实验思路。
实验设计
脂类合成的实验,C57BL6小鼠用溶媒对照和全身性小分子微粒体甘油三酯转移蛋白(MTP)抑制剂治疗。一小时后,给小鼠注射150 mg/kg油酸、钾盐(13C18,98%)CP 95%(CLM-8856)和玉米油(图2)或20%TPGS(图3)。在给药示踪剂后的连续时间点提取血样并处理成血浆。将10µL血浆与90µL标记内标物的甲醇溶液混合,并用300µL戊醇进一步稀释。将样品短暂离心至颗粒不溶性蛋白质,并通过超高效液相色谱(与三重四极(Waters Xevo TQ)或四极飞行时间(Waters Synapt G2)质谱仪连接)分析5-10µL上清液。实验中,其中一种脂肪酸是全氘化棕榈酸(D31, 98%) (DLM-215)、硬脂酸(D35, 98%) (DLM-379)、油酸(D33, 98%) (DLM-1891),其余两种是未标记的,或者三种脂肪酸都是全氘化的。将10µL血浆与丙酮在碱性pH下培养,以将血浆水中的氘与丙酮交换。然后用顶空气相色谱法结合同位素比值质谱仪(Thermo-Scientific)测量丙酮中氘的富集。有关这些实验中所采用方法的更多细节,请参阅参考文献。
数据分析
总血浆甘油三酯分析采用商业化生化试剂盒方法(Thermo Scientific)。所有其他数据均使用Waters或Thermo instrument软件包采集和分析。在三重四极质谱仪上进行多重反应监测,以跟踪血液中所选甘油三酯和胆固醇酯中油酸、钾盐(13C,98%)95%CP的出现。13C油酸标记脂质的浓度由分析物的峰面积与匹配的重标记内标物的比值确定。将浓度绘制为时间的函数,并使用Graphpad Prism软件包确定曲线积分面积。或者,从四极离地时间仪器上获得的全扫描MSe光谱中手动挖掘数据。提取选定的离子色谱图,并根据与类别特定内标物的峰面积比确定每个13C油酸标记脂质的相对丰度。
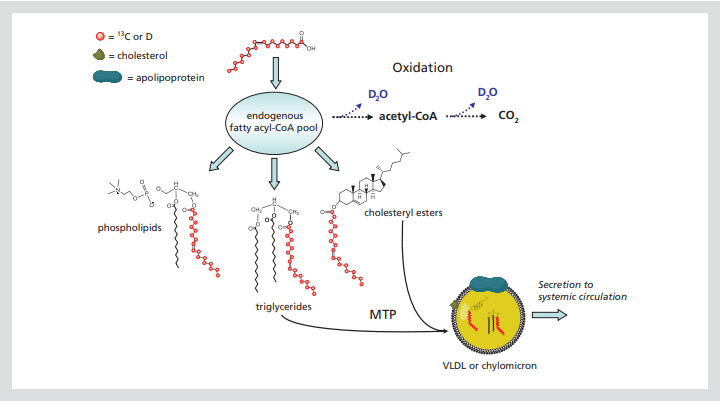
图1给出[13C]或[D]油酸并入较大脂质的示意图。同位素示踪剂进入普通脂肪酸池,在被合成磷脂、甘油三酯、胆固醇酯或其他脂质之前被激活为脂肪酰辅酶α。在肝脏和肠道中,微粒体甘油三酯转移蛋白(MTP)有助于将甘油三酯和胆固醇酯包装成VLDL或乳糜微粒脂蛋白颗粒,以便分泌到体循环中。或者,[D]油酰辅酶α可以氧化成D2O和CO2。
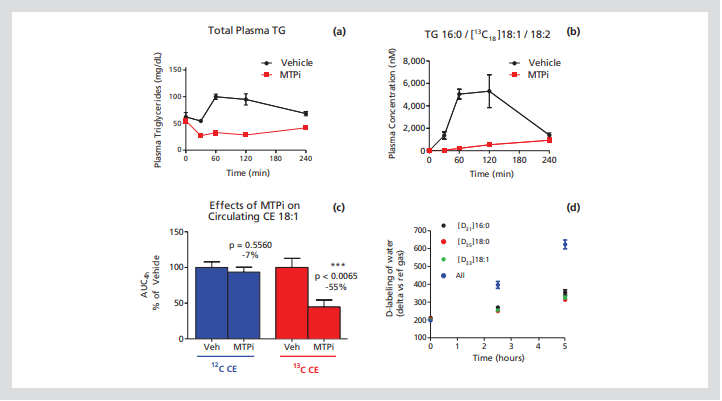
图2。小鼠体内脂质合成和脂肪酸氧化的测定。图(a)显示了MTP抑制剂对口服玉米油脂质的小鼠血浆总甘油三酯水平的影响。图(b)显示了测量甘油三酯偏移变化的窗口的改进,通过使用稳定同位素标记的脂肪酸来区分新合成的脂质和内源性背景。图(c)显示了与应用于在实验的4小时时间过程中对循环胆固醇酯水平的影响。图(d)显示,d-标记脂肪酸的氧化可用于通过测量血浆水中[d]的富集来研究氧化。
结果
特别是,我们研究了微粒体甘油三酯转移蛋白(MTP),它促进脂质在分泌到体循环之前转移到肠道和肝脏中生长的脂蛋白颗粒上(图1)。抑制MTP可防止乳糜微粒和VLDL颗粒的脂质化,从而防止脂质进入血液。图2所示的数据有助于说明使用稳定同位素示踪剂研究MTP抑制对复杂脂质代谢的影响的一些优势。图(a)显示了单剂量MTP抑制剂对口服玉米油后内源性(即未标记)血浆甘油三酯总量的影响。虽然MTP抑制剂的作用可以非常清楚地观察到,但预先存在的循环甘油三酯的基础水平(30-50毫克/分升)在测量动态变化的窗口上建立了一个下限。图(b)显示了来自同一个实验的数据,但是是由棕榈酰、亚油酸和13C油酰脂肪酸组成的特定甘油三酯的数据。因为在引入示踪剂脂肪酸之前,该物种不存在于系统中,因此没有背景水平,时间零点样品是真正空白的。由于完全抑制新的甘油三酯进入系统现在是可行的测量,我们实现了理论上的最大窗口测量动态变化应对药物干预的影响。图(c)比较了急性剂量MTP抑制剂对循环中油酸胆固醇水平的影响。与甘油三酯相比,胆固醇酯在体内的转化相对较慢,单剂量给予MTP化合物对这种脂质的内源性池没有影响。与此形成鲜明对比的是,通过集中分析新合成的酯(即用油酸示踪剂标记的酯),我们能够观察到进入系统的新脂质的数量显著减少。图(d)说明,脂肪酸氧化也可以在体内使用非常类似的实验方法进行测量。在这个实验中,我们感兴趣的是确定脂肪酸的性质(棕榈酸和硬脂酸)与油酸酸)会影响正常小鼠的氧化水平。如图所示,无论使用哪种脂肪酸作为示踪剂,都获得了血浆水氘富集的可比数据。
此外,当给药含有所有三种脂肪酸的全氘化形式的混合物时,血浆水的富集程度大于实验中仅标记一种脂肪酸时所观察到的水平。原则上,也可以设计实验,通过简单地使用[D]-而不是13C标记的脂肪酸来测量合成,同时测量脂质合成和脂肪酸氧化。
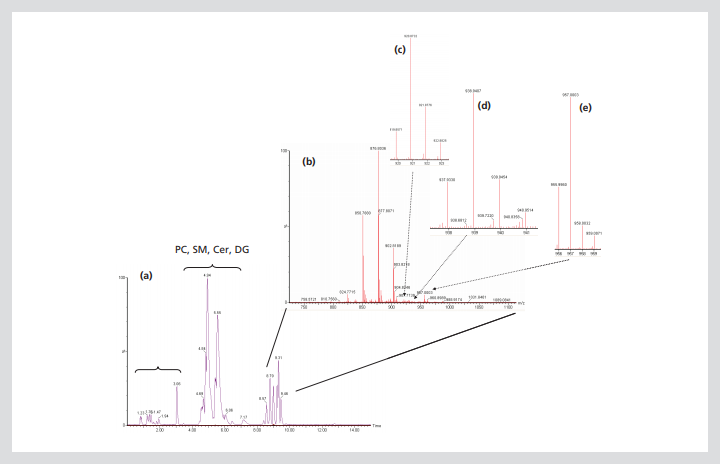
图3。采用超高效液相色谱-四极飞行时间质谱联用技术对小鼠血浆中油酸、钾盐(13C18,98%)和95%的CP掺入脂质进行非靶向分析。面板(a)显示了完整脂质剖面的总离子色谱图;面板(b)显示了8.5到10分钟的部分质谱(已知甘油三酯和胆固醇酯可以洗脱);图(c)、(d)和(e)分别显示了将1、2和3当量油酸、钾盐(13C18,98%)CP 95%掺入三油酸甘油的扩展光谱。这一数字突出了在存在大量内源性脂质的情况下检测到低水平的稳定同位素标记脂肪酸。
讨论
同位素示踪剂研究生物化学的一个原则是同位素的引入不应干扰正在研究的路径。简单地说,示踪剂的数量应该足够少,以免显著改变被追踪的最终产品的数量。为了实现这一点,需要非常灵敏的分析方法来测量示踪剂的丰度。在这里探讨的例子中,我们使用13C标记的脂肪酸作为合成复合脂质(产品)的前体。通过使用超高效液相色谱和质谱检测,我们能够在存在大量内源性(即未标记)复合脂质的情况下测量非常少量的13C标记产物。
图3(a)显示了小鼠血浆的总离子色谱图,通过UPLC-qTOF-MS分析获得的脂质谱,包括溶血磷脂,磷脂,甘油二酯,神经酰胺,甘油三酯和胆固醇酯。图3(b)显示了MS从UPLC洗脱到质谱中的甘油三酯的光谱分光计在8.5到10分钟之间。可以看出,各种不同质量的甘油三酯(基于在脂肪酸链长度和不饱和度的排列)存在于血浆提取物中。举一个例子,m/z 902.8189处的峰对应于三油酸甘油酯,一种含有三当量油酸的甘油三酯。在采集和处理血浆之前,本实验中的小鼠口服了低剂量的油酸、钾盐(13C,98%)CP 95%(在没有任何其他天然脂肪酸的情况下)。图(c)–(e)是选定光谱特征的放大图对应于三油酸甘油酯的各种同位素。m/z 920.8732、938.9407和957.003处的峰分别代表含有一个、两个或三个13C油酸当量的三油酸甘油酯的不同分子。最强烈的13C油酸标记同位素出现在m/z 957.003处,并且存在于约1/5浓度的未标记内源性三油酸甘油酯处。就总量而言,检测到的所有13C油酸标记甘油三酯的总和不到总未标记(内源性)甘油三酯浓度的1%,说明在不干扰自然生物学的情况下进行这些示踪研究的可行性。
采用稳定同位素示踪方法研究脂质动力学有许多实际益处。一个主要优点是在没有稳态效应的情况下,能够区分动态脂质合成和处置的急性效应。如图2(c)所示,MTP抑制确实对血液中肠源性新合成胆固醇酯的外观有直接影响,尽管酯的总水平在实验期间没有变化。在小鼠身上获得的这些结果与已经被其他人在人类身上观察到的结果相似。虽然急性剂量的MTP抑制剂在人体内被证明能降低VLDL胆固醇含量,但总胆固醇和LDL胆固醇在24小时内没有改变。然而,延长治疗时间确实会导致三天给药后总胆固醇和低密度脂蛋白胆固醇的变化。通过使用稳定同位素示踪剂来区分新合成的胆固醇酯和预先存在的胆固醇酯,可以在更短的时间内得到这种化合物的作用指示。示踪剂方法的另一个相关优点是改进了测量脂质合成动态变化的窗口。通过检查图2(a)和(b),我们可以看到一个大约两倍的窗口可用于测量血浆总甘油三酯的变化。如果这是可以观察到的最大变化,并且对这些测量中受试者之间的可变性有一定的了解,则可以进行统计功率计算,以确定需要观察血浆TG特定百分比变化的受试者人数。相反,示踪数据提供了一个大约7倍的窗口来测量这种变化。基于这一数据集,功率计算表明,示踪方法有能力检测新的甘油三酯合成的变化,使用的受试者比传统的基于测量总甘油三酯变化的方法少5到6倍。
这些例子强调在进行药物研究时,使用稳定同位素示踪剂具有实际和道德意义。通过使用稳定同位素示踪剂来评估新候选药物对临床前物种的影响,我们可以减少完成特定研究所需的动物数量。这一点的延伸是,我们还可以在更短的时间内完成个别研究,从而更快地做出明智的决定。因此,这些方法有可能减少开发新药的成本和时间,希望能够发现治疗疾病的新方法,并为需要的患者更快地推进有效疗法。
相关产品
CLM-8856 Oleic acid, potassium salt (13C18, 98%) CP 95%
DLM-1891 Oleic acid (D33, 98%)
DLM-215 Palmitic acid (D31, 98%)
DLM-379 Stearic acid (D35, 98%)
New Fatty Acids & Lipids

